Основные методы мониторинга болезней пшеницы. Часть 4
Интегрированная защита растений состоит из 4 блоков: мониторинг за вредными организмами, анализ информации, установочные и корректирующие мероприятия. При этом мониторинг должен обеспечивать регулярный сбор информации об абиотических элементах среды и популяциях вредных организмов (Гулий, Миняйло, 1989).
Продолжение. Начало читайте:
Для составления краткосрочного прогноза и своевременного проведения химической защиты посевов необходимо постоянно следить за распространением и динамикой развития болезней, особенно за ржавчиной, септориозом, пиренефорозом и другими. Для этого выбирают 2-3 типичных стационарных участка или поле и по основным фазам развития растений проводят наблюдения: в благоприятные для заражения растений и развития болезней погодные условия еженедельно или один раз за декаду. Общий мониторинг фитосанитарного состояния проводится в период массового распространения болезней, охватываются им посевы, размещенные по разным предшественникам, посеянные в разные сроки, сортовое разнообразие культур [рис. 39].
Глазомерную балловую оценку интенсивности развития болезней обычно проводят по следующей шкале:
0 балла – растения здоровые;
1 балл – слабое поражение органа или растения;
2 балла – умеренное поражение, сильно пораженных органов или растений нет;
3 балла – среднее поражение, у некоторых органов или растений – сильное;
4 балла – сильное поражение органов и гибель растений.
При равномерном распространении заболевания учет болезней можно проводить с любой стороны поле, отступив от края 25-50 м, заходя вглубь посева до 100-200 м, анализируется определенное количество растений или отбирают пробы стеблей или листьев по треугольнику или произвольно из 7-10 площадок, при неравномерном (очажном) – по диагонали поле.

Рисунок 39. Мониторинг болезней пшеницы в зависимости от фазы развития и химические мероприятия проводимые для защиты её посевов
При учете болезней устанавливают 2 показателя: распространение, или количество пораженных растений в посевах, интенсивность или степень развития.
Распространение болезней (Р) определяют по формуле:
Р = n × 100 / N,
где: N – общее количество растений в пробах;
n – количество больных растений.
Средневзвешенный процент распространения (Р0) болезни вычисляют по формуле:

где: ∑SP – сумма произведений площади полей на соответствующий процент распространения болезни;
S – обследованная площадь, га.
Интенсивность развития болезней (R) в процентах или баллах определяют по формуле:

где: ∑ab – сумма произведений пораженных растений на соответствующий им балл или процент поражения;
N – общее количество учетных растений в пробах;K – наивысший балл шкалы.
Для получения более точных результатов используются специальные шкалы, характеризующие интенсивность развития той или иной болезни. Ниже приводятся методы учета основных групп болезней пшеницы.
Мониторинг болезней с воздушно-капельной инфекцией
Виды ржавчины
Для своевременной обработки посевов фунгицидами с целью предотвращения больших потерь урожая зерна от ржавчины и других болезней с аэрогенной инфекцией нужно постоянно следить за их появлением и распространением. В районах, где возделывают озимую пшеницу и рожь, учет ржавчины проводят с осени при появлении 2-3 листьев. Весной после их отрастания (апрель-май) на 10 площадках поле анализируют не менее 100-200 растений (листьев) и определяют распространение ржавчины и степень ее развития. По основным фазам развития яровой пшеницы ведут регулярные учеты и устанавливают сроки заражения посевов, распространение видов ржавчины, септориоза и других. При обнаружении признаков болезни через каждые 25-50 шагов берут 5-10 проб по 10-15 растений или стеблей. В лаборатории проводят детальный анализ, учитывая количество больных растений, степень поражения листьев или стеблей отдельно для каждой болезни. Интенсивность или степень развития ржавчины определяют в процентах по шкалам: бурой – Русакова, желтой – по Маннерсу, стеблевой по видоизмененной Коббом-Петерсона [рис. 40 и 41] и результаты заносят в полевой журнал или компьютерную программу.
В зависимости от приуроченности возбудителей болезней к определенным органам в течение онтогенеза растений анализируются листья различного яруса, междоузлия стеблей и колос. Если учет проводится в период трубкования-колошения, то анализируются 2 листа нижнего и среднего яруса, в период налива зерна – верхние 2 листа, включая флаговый. Последний учет бурой и желтой ржавчины проводят в фазу молочно-восковой спелости, стеблевой – в период восковой или полной спелости зерна [табл. 90].
Наблюдения за урединиоспорами ржавчины в приземном слое воздуха, атмосфере и осадках. Для определения сроков заражения растений видами ржавчины нужно вести постоянный мониторинг за содержанием их спор в воздухе и выпадаемых осадках. Наиболее аспространенным и доступным методом анализа заноса спор воздушным потоком является улавливание их флюгерным приспособлением [рис. 42] или спороловушками типа ПЛС-71 и ПЛС-71М. Оно проводится в период возможного развития ржавчины на пшенице: от фазы кущения до начала налива зерна. Приборы устанавливают среди посевов, предметные стекла, смазанные вазелином или касторовым маслом, следует менять через 2-3 дня. На наклейку записывают название или географические координаты наблюдательного пункта, число и месяц. Анализируются в лаборатории при слабом увеличении микроскопа (8 × 20 или 10 × 20). При отсутствии спор или небольшом их количестве просматривается вся поверхность предметного стекла, при наличии 1-2 спор – 2/3; 3-4 спор – 1/2, 5-10 – 1/3; более 10 спор – 1/5 его поверхности. Определяется вид ржавчины, число спор учитывается в 10 полях зрения микроскопа, как при определении заспоренности семян телиоспорами твердой головни.

Рисунок 40. Шкалы для оценки степени пораженности листьев пшеницы ржавчиной: (а) Русакова – бурой ржавчины, (б) Маннерса – желтой ржавчины

Рисунок 41. Модифицированная Коббом шкала Петерсона (Peterson et all. 1965) для оценки степени пораженности листовой и стеблевой ржавчиной
Таблица 89. Основные органы для учета болезней пшеницы с воздушно-капельной инфекцией

Для получения данных о наличии спор ржавчины, оседающих с осадками, проводят анализ дождевой воды. Для этой цели применяют прибор, состоящий из воронки диаметром от 15 до 24 см, со стеклянной трубкой длиной 20-30 см и диаметром 44 мм. В нижней её части устанавливают микрофильтр, который пропускает воду, но задерживает споры грибов [рис. 43]. После каждого дождя анализируется содержание спор ржавчины и других патогенов на фильтре путем центрифугирования и микроскопирования осадков.
Количество урединиоспор на 1 м 2 площади рассчитывают по формуле:

где: N – количество спор на 1 м 2 , шт;
n – количество спор на всей поверхности фильтра, шт;
S – площадь верхней горизонтальной части воронки, см 2 .
Если в период стеблевания пшеницы в течение суток в воздухе и осадках улавливаются две и более спор ржавчины на 1 см2 и условия для заражения растений благоприятные, то следует ожидать массовую вспышку болезней через 7-10 суток. Возникновение эпифитотий ржавчины возможно при обнаружении 10-15 спор на 10 см2 в период колошения пшеницы.

Рисунок 42. Флюгер для улавливания спор ржавчины в воздухе Рисунок 43. Прибор для учета спор ржавчины в дождевой воде
Со дня обнаружения урединиоспор гриба в приземном слое воздуха необходимо постоянно следить за относительной влажностью, среднесуточной температурой и появлением первых урединий гриба на листьях и стеблях. Важное значения для заражения растений имеет наличие росы. Заражение пшеницы бурой ржавчиной при средней температуре от 10 до 15°С происходит при продолжительности росяного периода более 5 часов, от 16 до 20°С сокращается до 4 часа.
Скорость развития возбудителей ржавчины зависит от температуры воздуха. Время, необходимое для одной генерации гриба, можно определить по формуле:

где: n – продолжительность генерации, сутки;
С – сумма эффективных температур для развития одной генерации, °С;
Т – среднесуточная температура воздуха, °С;
t – нижний температурный порог развития грибов.
Сумма эффективных температур, т.е. среднесуточных, превышающих нижний порог развития возбудителя бурой ржавчины, составляет 85°С, стеблевой – 125, желтой – 171, нижние пороги – 1,9, –2 и –0,7°С соответственно (методические указания, 1981; 1982). Пользуясь специальными номограммами или моделями можно прогнозировать интенсивность поражения посевов пшеницы видами ржавчины к молочно-восковой спелости зерна и возможные потери урожая зерна, определить необходимость химической защиты посевов от болезни и оптимальные сроки ее проведения.
Идентификация урединиоспор возбудителей ржавчины. У стеблевой ржавчины они имеют эллипсоидальную форму и четкий контур из-за окрашенной оболочки, бурой и желтой ржавчины -шаровидные или округло-овальные, примерно одинакового размера. Оболочка урединиоспор желтой ржавчины бесцветная, 1-2 мкм толщины, покрыта очень мелкими шипиками и 10-12 ростковыми порами; у бурой ржавчины 1-2 мкм толщины, густо покрыты маленькими шипиками, с 8-10 ростковыми порами.
Пятнистости листьев, мучнистая роса
Распространение и степень развития видов септориоза, желтой пятнистости или пиренефороза учитывают одновременно с ржавчиной. Для определения степени пораженности листьев можно использовать унифицированную шкалу Джеймса показателями: 1, 5, 10, 25, 50 и 100% [рис. 44а], колосьев – 5, 10, 25 и 50% [рис. 44б].
В регионах, где возделывают озимую пшеницу, наблюдения за мучнистой росой проводят осенью, продолжают весной следующего года, на яровой пшенице – от стеблевания до колошения. Степень пораженности листьев и других органов определяют по видоизмененной шкале Э.Э. Гешеле [рис. 45].
Виды головни, корневые гнили и другие болезни
Виды головни учитывают в период восковой или полной спелости зерна при апробации посевов. Для этого по диагонали поля через равные расстояния (50-100 метров) проверяют на корню или отбирают для детального анализа 1000 стеблей (по 25-50 с каждой площадки), пыльную легко определить во время цветения пшеницы. При анализе апробационного снопа учитывают все виды головни.

Рисунок 44. Шкалы для оценки пораженности листьев (а) и колоса (б) пшеницы грибными пятнистостями

Рисунок 45. Шкалы СИММИТ для оценки реакции и степени пораженности пшеницы видами ржавчины
Корневые гнили. Учет пораженности пшеницы болезнью проводят в фазу 2-3 листьев и перед уборкой урожая: через каждые 25-50 метров берут 10 проб, вырывая с корнем 10-20 растений с каждой площадки. В лаборатории их анализируют, пораженность всходов определяют в баллах по шкале ВИЗР:
0 балла – признаки болезни отсутствуют;
0,1 балла –единичные штрихи на колеоптиле;
1 балл – слабое побурение колеоптиле;
2 балла – умеренное побурение колеоптиле;
3 балла – сильное побурение, проникающее под колеоптиле;
4 балла –погибший проросток.
В фазу восковой или полной спелости зерна проводят второй учет, пробы отбирают аналогично, как в фазу всходов, или можно использовать апробационные снопы. В лаборатории основание корня очищается от листьев, определяется степень развития болезни по 4-х балльной шкале [рис. 46].
0 балла – здоровые растения;
0-1 балл – у основания стебля или у его подземной части бурые штрихи или полосы, занимают до 1/5 части пораженного органа;
2 балла – коричневые полосы или пятна, охватывающие от 25 до 50% поверхности пораженного органа;
3 балла –сильное побурение первого стеблевого и подземного междоузлия;
3-4 балла – отсутствие продуктивных стеблей при наличии симптомов по баллу 3.
3-4 – При отборе проб растений на корневую гниль в 10 точках берут почву весом 1-2 кг, инфицированность её возбудителем болезни определяют по методике Ледингама и Чина (1955). Просеивают её через сито диаметром 1 мм, взвешивают 10 г и помещают в пробирку 20×200 мм, приливают 5 мл веретенного или другого минерального масла, 30 мл водопроводной воды. Закрытую резиновой пробкой пробирку помещают в горизонтальном положении на ротатор и взбалтывают с постоянной частотой в течение 10-15 мин. После отстаивания пробирки в течение 1-1,5 ч, капли эмульсии объемом 0,01 мм просматривают на предметном стекле под бинокуляром или микроскопом при увеличении 40-80 × в 10-кратной повторности. Соответствующим пересчетом определяют количество конидий в 1 г почвы.

Рисунок 46. Шкала для оценки степени пораженности нижнего междоузлия пшеницы корневой гнилью
Вирусные и бактериальные болезни. В период колошения – молочной спелости зерна по диагонали поля на 10 площадках подсчитывают общее количество растений на 1 погонном метре и пораженных вирусными болезнями. Степень их проявления определяют по шкале Г.М. Развязкиной:
0 балла – здоровые растения;
1 балл – слабое поражение, листья с симптомами мозаики;
2 балла – среднее поражение, на листьях признаки мозаики;
3 балла – сильное поражение, листья ярко мозаичные, растения карликовые;
4 балла – погибшие растения.
Распространению бактериальных болезней пшеницы определяют при мониторинге листовой ржавчины и септориоза. Для оценки степени их развития на листьях и колосковых пленках можно использовать шкалы, рекомендованные для учета пятнистостей.
Методы фитоэкспертизы семян, экономические пороги их зараженности
Как известно, семена являются источником и участвуют в передаче инфекций многих болезней растений. Основными патогенами пшеницы, передающимися семенами, являются возбудители пыльной, твердой и карликовой головни, септориоза, гельминтоспориозной (Bipolaris sorokiniana) и фузариозной (виды Fusarium) корневых гнилей и бактериоза. Кроме того, в период формирования, уборки и хранения семена заселяются многочисленными эпифитными и сапрофитными грибами, в т.ч.: Alternaria, Cladosporium Trichotecium и др., а также плесневыми – виды Penicillium, Aspergillus, Mucor. Последние интенсивно развиваются при высокой влажности семян (15-16%) и снижают полевую их всхожесть. Возбудители «черного зародыша» пшеницы грибы A. tenuies и A. alternatа. Первый вид существенно не влияет на посевные качества семян и технологические свойства муки в связи с его локализацией в плодовой оболочке, а второй проникает глубже, поражая зародыш и снижает всхожесть.
В связи с изложенным необходимо определение зараженности семян инфекционными зачатками возбудителей болезней. Они присутствуют в виде примесей к семенам: телиоспор головни, конидий грибов, клеток и спор бактерий. Наиболее распространенными методами фитоэкспертизы семян являются визуальный, центрифугирование, биологический, бактериологический и анатомический анализы. В отдельных случаях применяют серологический и люминесцентный методы (Наумова, 1970; Кривченко с соавт., 1971).
Контрольный анализ семян пшеницы на грибную и бактериальную инфекцию проводят районные и областные инспекции Министерства сельского хозяйства, при необходимости лаборатории научно-исследовательских институтов и опытных станций.
Визуальный осмотр проводится одновременно с анализом чистоты семенного материала. При этом устанавливают наличие в зерне примесей головневых мешочков и рожков спорыньи. Семена рассыпают на стекло тонким слоем и делят линейкой на 4 треугольника, из каждого отбирают по 100 зерен и по шкале А.Г. Тороповой определяют степень пораженности их «черным зародышем»:
0 балла – здоровые семена;
0,5 балла –следы окрашивания зародыша размером с точку;
1 балла – потемнение зародыша и окружающей ткани;
2 балла – потемнение охватывает за пределами зародыша до ½ поверхности зерна;
3 балла – то же более ½ поверхности зерна.

Рисунок 47. Схема фитоэкспертизы семян пшеницы на зараженность грибной и бактериальной инфекцией
Для анализа зараженности семян комплексом патогенов проводятся дополнительные анализы методами: на заспоренность твердой головней – центрифугирование, пыльной головней – гистологический, инфицированность септориозом и гельминтоспориозом – биологическим.
Путем обмывки и центрифугирование устанавливают заспоренность семян пшеницы телиоспорами наружных видов головни, а также конидиями грибов Helminthosporium, Fusarium, Alternaria, Septoria. Для этой цели из среднего образца отбирают 2 пробы по 100 зерен, их помещают в чистые пробирки, заливают 10 мл воды и взбалтывают. После этого воду сливают в специальные пробирки и центрифугируют в течение 5 минут при оборотах 1 000-1 500. Из пробирки сливают воду, осадок взмучивают, наносят каплю его на предметное стекло и просматривают под микроскопом в 10 поле зрения. Данные суммируют и определяют среднее количество спор головни для каждой пробы по формуле:

где: Х – число спор на 1 зерно;
А – среднее число спор на 1 поле зрения микроскопа;
К – постоянный коэффициент: произведение числа полей микроскопа, размещающихся на покровном стекле, умноженное на число капель в 0,5 мл.
Площадь поля зрения микроскопа определяют по формуле:

где: π – постоянное число, равное 3,14;
R – диаметр поле зрения микроскопа.
Диаметр поля зрения микроскопа измеряют посредством объективного микрометра при определенном увеличении, затем подсчитывают число делений в одном, которое умножают на величину деления.
Биологический метод. Из исходного образца семя отбирают по 50 зерен и анализируют их во влажной камере. Для этого на стерильное дно чашки Петри кладут 2-3 слоя фильтровальной бумаги или кружочки марли, увлажняют их стерильной водой. Для выявления внутренней инфекции семена предварительно дезинфицируют в 0,5% растворе перманганата калия (KMnO4) в течение 5 минут или 0,1% растворе формалина, затем промывают стерильной водой. Чашки Петри с высеянными семенами инкубируют в термостате при 20-25°С течение 5-7 суток. Затем их анализируют визуально или при слабом увеличении микроскопа.

Рисунок 48. Фитоэкспертиза семян пшеницы в стерильном песке (а) и на фильтровальной бумаге (б) для определения зараженности грибной инфекцией
Для анализа зараженности семян пшеницы гельминтоспориозной, альтернариозной и фузариозной инфекциями проращивают по 20-25 зерен в 4-5 – кратной повторности при температуре 25°С в чашках Петри на увлажненном песке или фильтровальной бумаге. На 7-е сутки просматривают их визуально, при наличии спороношения грибов при слабом увеличении микроскопа по морфологии конидии определяют видовой их состав.
Возбудители многих грибных и бактериальных болезней хорошо растут на искусственных питательных средах. Поэтому, для определения инфицированности семян и грибной или бактериальной инфекцией, идентификации возбудителей наряду с влажной камерой могут быть использованы синтетическая среда Чапека и картофельный агар.

Рисунок 49. Проращивание семян на бумажных рулонах для установления пораженности их грибной и бактериальной инфекцией

Рисунок 50. Колонии грибов Bipolaris sorokiniana (а), A. tenuies (б), Fusarium spp (в) на искусственной питательной среде
Гистологический метод применяется для определения зараженности семян пшеницы пыльной головней. Кипятят их в колбе в 3%-ном растворе КОН или NaOH (из расчета 100-150 мл раствора на (100-120 зерен), на ситах размером 5, 3 и 1 мм зародыши отделяют от эндосперма и тщательно промывают водопроводной водой. В течение 2-4 минут окрашивают их в 1%-ном растворе анилинового синего, приготовленного в 40-45% уксусной кислоте, затем зародыши промывают в молочной кислоте для удаления лишней краски. В этом растворе их можно оставить на 2-3 дня (Кривченко, 1985).
Серологический метод применяется для диагностики бактериальных болезней пшеницы. Капельный метод, разработанный М.С. Дуниным и Н.Н. Поповой, позволяет идентифицировать возбудителей черного и базального бактериоза пшеницы. Для этого на предметном стекле смешивают специальную сыворотку с чистой культурой бактерий. При положительной реакции выпадает осадок, заметный невооруженным глазом.
Люминесцентный анализ. Семена пшеницы раскладывают в один ряд на черной бумаге, затем их на расстоянии от 15 до 30 см помещают под ртутно-кварцевую лампу. При этом здоровые семена дают сине-голубую или сине-фиолетовую флуоресценцию, а зараженные пыльной головней – не флуоресцируют, имеют тусклый вид. При поражении семян грибами из родов гельминтоспориум, фузариум и патогенными бактериями наблюдается аналогичная реакция.
На основе анализа результатов многолетних экспериментальных исследований и обобщения литературных данных разработаны предельно допустимые показатели пораженности колосьев головней, инфицированности семян и зараженности почвы возбудителем коревой гнили [табл. 91].
При зараженности семян выше указанных показателей рекомендуется обязательное их протравливание. Минимальные индексы инфицированности берутся при возделывании восприимчивых сортов или неблагоприятной фитосанитарной ситуации, а максимальные – для сравнительно устойчивых сортов и при благоприятных для роста и развития растений погодных условий.
Таблица 91. Критические параметры инфицированности семян и почвы возбудителями болезней
Диагностика

Диагностика – распознавание причин патологического состояния и постановка диагноза путем тщательного и всестороннего исследования больного организма (растения) [2] . В рамках фитопатологии, как науки, диагностика сегодня является обособленным направлением, представляющим крупное научное течение, занимающееся изучением и совершенствованием методов распознавания болезни растения [4] .
Постановка диагноза – это установление типа болезни, его характера (инфекционное или неинфекционное), причины, возбудителя заболевания и выбор соответствующих мер борьбы.На данном этапе развития науки имеются несколько методов диагностики: макроскопический (патографический), микроскопический, микологический, химический, физический, молекулярный [2] . Наиболее прогрессивной является молекулярная диагностика [5] .
Содержание:
Макроскопический (патографический, визуальный) метод диагностики
Макроскопический метод диагностики – позволяет ставить диагноз по видимым невооруженным глазом внешним признакам (симптомам). При необходимости используется незначительное увеличение (лупа, бинокль) [2] .
При использовании этого метода для правильной постановки диагноза необходимо:
- проанализировать большое количество растений, поскольку совокупность всех признаков заболевания встречается не на всех растениях или симптомы не всегда выражены ясно;
- тщательно осмотреть и оценить состояния больных растений от корней до вершины (точки роста);
- проанализировать условия местопроизрастания объекта;
- установить причины, способствовавшие возникновению болезни растения (антропогенные факторы, неблагоприятные погодные условия, поражение другими болезнями, повреждения насекомыми) [5] .

Исследование образца растения в лаборатории

Микроскопический метод диагностики
Микроскопический метод диагностики – исследование с помощью микроскопа спороношения возбудителя заболевания или пораженных тканей растения [2] .
Этот метод применяется для установления наличия патогена в тканях больного растения, то есть определения характера заболевания, и определения вида возбудителя болезни [2] .
Метод микроскопирования дает возможность установить наличие характерных признаков спороношения, свойственных тому или иному патогену и с помощью определителя установить его систематическое положение [2] .

Выращивание Sclerotinia sclerotiorum на питательной среде.

Микологический метод диагностики
Микологический метод диагностики – выделение инокулюма патогена из пораженных частей растения, его изоляции и выращивания (культивирования) на подходящей питательной искусственной или естественной среде [3] [2] .
Культивирование патогенов включает три основных этапа:
- подготовка образцов естественных субстратов (почвы, органов растений, растительных остатков), из которых осуществляют высев на обычные или элективные питательные среды, способные обеспечить развитие одного или группы родственных видов;
- выделение и получение чистой культуры патогена на питательных средах;
- пересев чистых культур на дифференциально-диагностические среды для определения их видовой принадлежности [3][2] .
Физический метод диагностики
Физический метод диагностики – основан на различных свойствах семян, тканей и органов больных и здоровых растений. Органы больных растений исследуются на резонанс, свечение в ультрафиолетовых лучах, цвет клеточного сока, электропроводность, плотность [2] .
В частности, качество семян можно определить по плотности, поскольку у больных и здоровых семян она различна. Скрытую гниль древесины первоначально устанавливают путем выстукивания, поскольку здоровые и фаутные стволы издают разные звуки [2] .
К физическим методам диагностики относится метод идентификации патогена с помощью индикаторного растения – метод индикаторных растений. Он основан на использовании растений-индикаторов, дающих специфичные симптомы, характерные для определенного вида возбудителя болезни. Метод индикаторных растений широко используется для идентификации вирусных, вироидных, фитоплазменных заболеваний [1] .
Молекулярные методы диагностики
Молекулярные методы диагностики – комплекс методов молекулярной детекции фитопатогенов, позволяющие провести точную диагностику на любой стадии развития заболевания [5] .
Различают три группы методов:
- Первая группа методов основана на выявлении специфичных химических соединений (маркерных молекул) для конкретного патогенна. В качестве маркерных молекул используются жирные кислоты, хинин, эргостерин. Наличие метаболитов выявляется с помощью хроматографии [5] .
- Вторая группа методов – спектр приемов иммунной диагностики. Эти методы сводятся к формированию в образце комплексов «антиген – антитело» и последующей визуализации полученных комплексов. Для визуализации применяют различные способы: фотометрия, флуореметрия, микроскопия иммунопреципитатов [4] .
- Третья группа методов основывается на различных вариантах протекания полимеразной цепной реакции (ПРЦ). Маркерные последовательности ДНК возбудителей болезни амплифицируются и визуализируются с помощью флуореметрии, электрофореза в ходе «ПЦР в реальном времени». Важное преимущество этой группы методов – возможность установления наличия и определения вида патогена даже при его незначительном (следовом) количестве [5] .
Большинство методов молекулярной диагностики характеризуются быстротой и простотой использования, позволяющей проводить исследования в условиях передвижных мини-лабораторий. На основе методов молекулярной диагностики выпускаются различные коммерческие наборы для выявления патогенов – диагностикумы [5] .
Диагностика болезней растений и современные технологии

Обзор
Иллюстрация с обложки книги Ю.Т. Дьякова «О болезнях растений»
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Фитопатология — это наука о болезнях растений, о том, как с этими недугами бороться и предупреждать их возникновение. Чтобы побеждать болезни, надо их правильно, точно и своевременно диагностировать. Есть много методов такой диагностики; в последние десятилетия, с развитием молекулярных методов анализа, активно разрабатываются всё новые и новые, постепенно вытесняя из практики классические подходы. О трудностях диагностики болезней растений и об основных путях их преодоления и будет рассказано в этой статье.

Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Чем болеют растения?
Для начала несколько слов о том, от чего, собственно, специалистам приходится защищать сельскохозяйственные растения. Причинами заболевания растений могут быть как факторы среды (летняя засуха или зимние морозы, недостаток питательных веществ в почве или их избыток и т.п.), так и различные паразитические организмы (бактерии, вирусы, грибы, круглые черви (нематоды) и даже другие растения).
Грибы, бесспорно, являются основными патогенами культурных растений. Известно, например, что из 162 серьёзных заболеваний в Центральной Европе 135 (83%) вызываются грибами [2]. Фитопатогенные грибы — многочисленная группа; их описано свыше 10 000 видов, различных по систематическому положению, степени паразитизма, специализации и т.д. [3]. Они широко распространены в природе и при благоприятных для их развития условиях наносят значительный урон урожаю и сельскохозяйственным продуктам при хранении. Даже самые осторожные оценки говорят об уничтожении болезнями 10–20% потенциального урожая; без контрмер масштабы этих потерь резко возросли бы [2].
Именно о проблемах диагностики болезней растений, вызываемых фитопатогенными грибами, пойдёт речь в данной статье.
Врага надо знать в лицо
Зачем же нужно, с одной стороны — обнаружение, а с другой — быстрое и точное (желательно — до вида, или даже расы) определение фитопатогенных грибов?
На данный момент самым распространённым методом борьбы с фитопатогенными грибами является обработка растений фунгицидами. Понятно, что невозможно защитить культуры от всех возможных потенциальных угроз: это и сложно, и экономически невыгодно, да и для окружающей среды далеко не полезно. Именно поэтому важно знать, желательно — своевременно, с чем именно придётся бороться. Чем раньше обнаружена болезнь, тем больше шансов, что, приняв соответствующие меры, удастся её победить. Это верно для заболеваний как человека, так и растений. Кстати, точное определение вида грибов важно ещё и в довольно неожиданной области — реставрации деревянных строений — поскольку используемые там антисептические меры также очень сильно зависят от типа поражения [4].
Кроме этого, идентификация фитопатогенных грибов необходима для изучения их таксономии и эволюции, их взаимоотношений с растениями-хозяевами, генетических основ восприимчивости и устойчивости растений, что, в конечном счете, должно помочь в разработке способов борьбы с патогенами и в селекции растений, невосприимчивых к болезням [5].
И, наконец, крайне важна сертификация зерна и посадочного материала в рамках карантинных программ. Известно, что фитопатогенные грибы могут распространяться многими путями — как естественными (с током воздуха, водой, насекомыми, животными), так и при помощи человека, перевозящего заражённые растения или их части не только между различными странами, но и между континентами. Зачастую такое перемещение приводит к неожиданному и масштабному распространению заболеваний.
Например, пузырчатая ржавчина (Cronartium ribicola) была эндемична для Альп и востока России. Этот паразит, в цикле развития предполагающий обязательную смену хозяев, обитает круглый год на пятихвойных соснах, а летом поражает листья смородины; ни в одном из исходных ареалов он не причинял серьёзного ущерба. Однако веймутова сосна, завезённая в начале XVIII века из Америки в ряд областей Европы, оказалась крайне восприимчивым хозяином для данного гриба. За счёт этого распространившаяся инфекция причинила большой вред культурам смородины и высаженным веймутовым соснам, а в 1909 году была завезена с их рассадой в Америку, где встретила многочисленных хозяев для обеих фаз развития. Здесь стали страдать, прежде всего, лесообразующие пятихвойные сосны. Поэтому, чтобы разорвать инфекционную цепь паразита с обязательной сменой хозяев, пытаются уничтожать дикорастущие виды смородины [2].
Ещё один показательный пример: возбудитель голландской болезни вяза (Ophiostoma ulmi) уже в XX столетии был занесён из континентальной Европы в Северную Америку. Начиная примерно с 1970 г., после того, как он был завезён в Великобританию, он успел уничтожить половину английских вязовых насаждений [2]. Теперь этот вид встречается и в России.
Для того чтобы избежать подобного впредь, созданы списки карантинных организмов, и при перемещении растений или их семян между странами (или даже частями одной страны) обязательно проводится их обследование.
«Классические» методы диагностики и трудности в их применении
Как только что было показано, идентификация фитопатогенных грибов крайне важна, возник вопрос — каким образом она производится?
Наиболее простой способ — это идентификация патогена по внешним признакам заболевания (симптомам), то есть по тому воздействию, которое он оказывает на поражённое растение [6]. Но здесь проблема в том, что к одним и тем же повреждениям растения-хозяина могут приводить совершенно разные микроорганизмы, отличающиеся разной устойчивостью к фунгицидам, вредоносностью и другими характеристиками. Как пример, здесь можно привести три листовые пятнистости пшеницы (рис. 1).

Рисунок 1. Листовые пятнистости пшеницы. Слева — септориоз листьев пшеницы (возбудитель — Mycosphaerella graminicola). По центру — септориоз листьев и колоса пшеницы, проявление на листьях (возбудитель — Phaeosphaeria nodorum). Справа — жёлтая пятнистость пшеницы (возбудитель — Pyrenophora triticirepentis). Обратите внимание: несмотря на то, что это разные заболевания, поражения листьев очень похожи.
Ещё одна проблема заключается в том, что далеко не все заболевания проявляются сразу же после заражения растения. Например, возбудитель пыльной головни ячменя (Ustilago nuda) обычно проникает во время цветения пшеницы в формирующуюся зерновку. Гриб не препятствует формированию зародыша, само зерно развивается нормально, ничем внешне не отличаясь от здорового. Мицелий зимует в зерновке. Весной одновременно с прорастанием семян происходит и рост мицелия, который по мере роста растения распространяется по различным его органам. Проявляется заболевание только в период колошения. При этом разрушаются все части колоса, превращаясь в чёрную споровую массу, после распыления которой остаются лишь ости и стержень колоса (рис. 2) [8].

Рисунок 2. Пыльная головня ячменя: поражённое соцветие со спорами
Стандартный для фитопатологов подход при определении фитопатогенных грибов — это выделение их в чистую культуру на какой-либо питательной среде, получение характерных образований (чаще всего это, конечно, спороношения) и затем идентификация гриба под микроскопом.
Но здесь возникают определённые трудности. Основная из них заключается в том, что далеко не все паразитические грибы возможно культивировать на искусственных питательных средах: многим требуется наличие живых тканей растения-хозяина, либо присутствие других представителей сложного сообщества [10]. Но даже если гриб удаётся выделить в культуру, следующий вопрос — это то, сколько времени понадобится, чтобы добиться от него появления спороношения. Например, возбудитель белосоломенной болезни пшеницы и ржи (Gibellina cerealis), хотя и хорошо культивируется, даёт спороношение только после четырёх–пяти недель роста. Естественно, что меры по борьбе с патогеном необходимо принимать сразу после его обнаружения, а не через месяц, когда может оказаться, что спасать уже нечего.
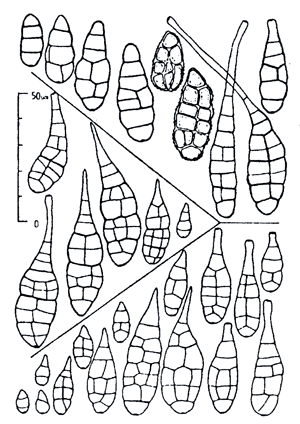
Рисунок 3. Сравнение конидий типовых образцов Alternaria longipes (вверху), Alternaria tenuissima (в центре), Alternaria alternata (внизу). Видно, что на основе сравнения только формы конидий этих трёх видов однозначно различить их крайне сложно. При идентификации видов в данном случае специалист использует не только форму конидий, но и другие признаки (например, способ образования конидий, их взаимное расположение и т.п.).
И даже с определением тех фитопатогенных грибов, спороношения которых получить сравнительно просто, могут возникать сложности. К примеру, идентификация многих микромицетов сопряжена с рядом трудностей, таких как сходство морфологических характеристик разных видов и одновременно внутривидовая вариабельность признаков. Несмотря на внешнее сходство, возбудители могут значительно отличаться по патогенности, токсигенности, степени специализации, генетике взаимоотношений с растением-хозяином, вредоносности, чувствительности к фунгицидам и т.д. То есть разные виды обладают совершенно разными экологическими особенностями и хозяйственной значимостью [12]. Хорошим примером здесь является определение различных видов рода Alternaria (рис. 3). Очевидно, что для идентификации до вида нужны достаточно широкие познания в данной области и немалый опыт работы с исследуемым фитопатогеном.
Ещё один способ, пригодный для обнаружения некоторых фитопатогенных грибов, заключается в смыве с субстрата, фильтрации и микроскопическом определении (и даже подсчёте, что даёт количественные данные) их спор. Чаще всего, таким способом оценивается количество грибных спор в зерне или в почве. Несмотря на то, что идентификация до вида на основании одних только спор чаще всего затруднена, этот способ широко применяется, а для анализа получаемых при помощи микроскопа изображений разрабатываются специальные компьютерные программы [14]. Например, таким образом определяют заражённость зерна возбудителем твёрдой головни (Tilletia caries) (рис. 4) [15]. Несмотря на использование компьютерных технологий, этот метод весьма трудоёмок и не подходит для исследования большого количества образцов.

Рисунок 4. Зерновки, поражённые твёрдой головнёй пшеницы
Молекулярная биология на службе фитопатолога
Во всех описанных случаях на помощь исследователям могут прийти широко развивающиеся в последнее время молекулярные методы анализа. Сейчас в основе большинства из них лежит применение ELISA (enzyme-linked immunosorbent assay, иммуноферментный анализ) [11], либо ПЦР (полимеразная цепная реакция, polymerase chain reaction) [17].
Иммуноферментный анализ состоит из двух основных этапов: иммунной и ферментативной реакций. Иммунная реакция заключается в специфическом связывании характерного для данного микроорганизма антигена с диагностическим антителом. Ферментативная реакция необходима для обнаружения этого связывания. Как правило, она сопровождается изменением цвета, причём степень этого изменения может быть использована для определения количества присутствующего антигена.
Есть много модификаций данного метода, бóльшая часть из которых применяется для обнаружения возбудителей болезней растений [16]. Особенно интересен так называемый «lateral flow assay» (анализ капли, растекающейся в радиальном направлении) (рис. 5), отличающийся высокой скоростью анализа и не требующий никакого специального оборудования или знаний. Используя такой набор (имеющий карманный формат), можно провести анализ непосредственно «в поле», так что не нужно даже отправлять образцы в лабораторию.
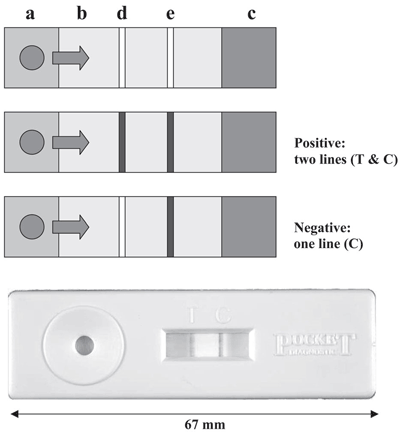
Рисунок 5. Прибор CSL Pocket Diagnostic TM lateral flow immunodiagnostic kit. Растительный экстракт помещается на площадку (a), которая содержит латексные шарики, покрытые специфическими антителами; смесь мигрирует вдоль мембраны (b) к абсорбирующей поверхности (c). При этом имеющиеся в растворе целевые антигены связываются со специфичными антителами на латексных шариках. Мембрана содержит полосу антител, отличающихся необходимой специфичностью (измерительную полосу) (d) и полосу других антител, которые связываются с первыми антителами (контрольную полосу) (e). Латексные шарики, содержащие связанный антиген, задерживаются в тестовой зоне, давая видимую линию, тогда как излишние латексные шарики, которые не содержат антигена, задерживаются в контрольной зоне, показывая, что анализ работает. Наличие двух линий соответствует положительному результату (positive), наличие только одной линии (контрольной) говорит о негативном результате (negative).
Основанные на иммуноферментном анализе методы широко применяются для обнаружения вирусов (в том числе поражающих растения) и значительно реже — для идентификации грибов и бактерий. Основной причиной этого является трудность получения антител с необходимой специфичностью: строение клеточных стенок грибов и бактерий гораздо сложнее, чем вирусного капсида, к тому же может изменяться в ходе их жизненного цикла. В результате получаемые антитела могут оказаться специфичны как сразу к большой группе видов, так и исключительно к отдельным жизненным формам данных микроорганизмов. Тем не менее, основанные на ELISA методы идентификации фитопатогенных грибов всё же разрабатываются: например, существует метод идентификации спор уже упоминавшейся в данной статье твёрдой головни [19].
ПЦР — это ферментативная реакция, в результате которой происходит накопление большого количества копий какого-либо не слишком большого (чаще всего, 200–1500 пар нуклеотидов) фрагмента ДНК. Так как ДНК любого организма содержит как вариабельные (отличающиеся даже у близкородственных организмов), так и консервативные (сходные у эволюционно далёких видов) участки, возможно на основе выбора диагностического участка варьировать специфичность протекающей реакции.
Таким образом, данный метод позволяет обнаруживать последовательности нуклеиновой кислоты, специфичные для конкретного организма или группы сходных организмов и, тем самым, выявлять его (их) присутствие в анализируемой пробе. Методы, основанные на ПЦР, позволяют идентифицировать патогенные виды как в чистой культуре, так и непосредственно в растительном материале, минуя этап изоляции грибов [20]. Как пример, здесь приведены результаты ПЦР, разработанной для идентификации грибов рода Pyrenophora (рис. 6), представители которого являются возбудителями жёлтой пятнистости злаков, в частности — пшеницы (рис. 1).
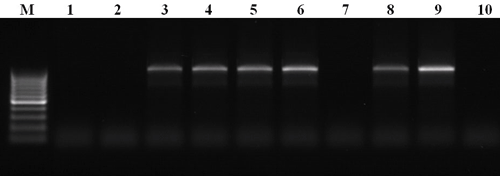
Рисунок 6. Разделённые при помощи электрофореза продукты ПЦР, разработанной для идентификации грибов рода Pyrenophora. М — маркер, представляющий собой набор фрагментов ДНК известного размера, 1–10 — ДНК, выделенная из различных образцов листьев пшеницы, поражённых листовыми пятнистостями. Здесь продукт реакции (фрагмент ДНК известного размера) должен наблюдаться только в том случае, если в образце присутствует ДНК целевого организма, а именно — гриба рода Pyrenophora. В итоге видно, что растения под номерами 3–6, 8 и 9 больны жёлтой пятнистостью, а остальные — каким-либо другим внешне схожим заболеванием.
Существует достаточно много модификаций метода ПЦР, большинство из которых применяется в изучении возбудителей болезней растений. Например, RAPD и RFLP анализы используются для уточнения родственных связей между различными грибами; ПЦР, специфичная для ДНК представителей отдельных родов или видов — для идентификации фитопатогенов (в том числе — в форматах nested и multiplex); ПЦР с регистрацией в режиме реального времени (real-time PCR) — для определения количества присутствующей целевой ДНК.
Рассмотрим подробнее один из самых перспективных методов на основе ПЦР — ПЦР с регистрацией в режиме реального времени (рис. 7). В отличие от большинства других форматов ПЦР, он позволяет не только констатировать факт присутствия ДНК целевого патогена, но и измерить её количество. В качестве примера здесь приведено определение в двух образцах количества ДНК ещё одного возбудителя листовой пятнистости.
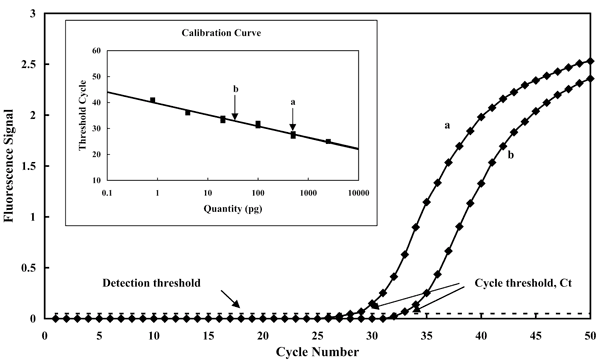
Рисунок 7. ПЦР с регистрацией в режиме реального времени. В ходе реакции непрерывно измеряется флуоресценция пробы (Fluorescence Signal), которая увеличивается по мере накопления продукта реакции (время реакции здесь выражено в числе циклов реакции — Cycle Number). Чем больше целевой ДНК было в смеси на момент начала реакции, тем быстрее происходит накопление продукта, и, соответственно, тем меньше будет номер цикла (cycle threshold, Ct), при котором флуоресценция пробы достигнет порогового значения (Detection threshold). Количество ДНК в исходной пробе определяют по калибровочному графику (приведён на вставке), соотносящему исходное количество целевой ДНК (Quantity) со значениями Ct. В данном случае на графике показано изменение во времени флуоресцентного сигнала для двух образцов, содержащих ДНК Mycosphaerella graminicola (рис. 1), причём кривая «а» соответствует образцу с большей концентрацией.
Интересно применение данного метода для анализа заражённости зерна твёрдой головнёй (рис. 4): при наличии соответствующих калибровочных графиков возможно получение результатов в виде числа спор, имеющихся в образце [7].
Ложка дёгтя в бочке мёда
Хотя преимущества и перспективы применения молекулярных методов идентификации сложно переоценить, на пути их практического использования имеется целый ряд трудностей. Несмотря на универсальность методов при конечном анализе, для их разработки и проверки требуется достаточно много времени и немалая экспериментальная база. Основной проблемой здесь является отсутствие возможности чисто теоретически оценить специфичность разрабатываемых методов.
Ещё одна сложность является прямым следствием высокой чувствительности данных методов (особенно — основанных на ПЦР). Ведь если анализ позволяет выявить в образце присутствие даже одной споры фитопатогенного гриба, или всего лишь нескольких копий его ДНК, то и для получения ложноположительного результата оказывается достаточно даже минимального загрязнения изначально «чистого» образца. Следовательно, требования к стерильности оказываются крайне высоки на всех стадиях анализа, но всё равно всегда приходится использовать отрицательные контроли.
Ну и самая большая проблема всех описанных в данной статье методов — это цена, ограничивающая их широкое применение в условиях небогатых российских хозяйств.
Несколько слов о будущем
Несмотря на все имеющиеся проблемы, молекулярные методы анализа интенсивно развиваются (о чём можно судить хотя бы по числу публикаций на соответствующие темы, которое с каждым годом становится всё больше). Старые методы постоянно совершенствуются, в то же время разрабатываются новые (например, метод биочипов [21] и секвенирование следующего поколения [22]), а цена одного анализа становится всё ниже. Поэтому можно надеяться, что не за горами то время, когда все упоминавшиеся в данной статье методики и их более совершенные аналоги действительно найдут широкое применение и облегчат жизнь фитопатологов и агрономов.
Источник https://agrovesti.net/lib/tech/growing-cereals/osnovnye-metody-monitoringa-boleznej-pshenitsy-chast-4.html
Источник https://www.pesticidy.ru/dictionary/Diagnostics
Источник https://biomolecula.ru/articles/diagnostika-boleznei-rastenii-i-sovremennye-tekhnologii